医疗器械工艺用水验证方案
1、概述
2、验证/再验证目的
3、适用范围
4、引用文件
5、验证/再验证日期
6、验证/再验证小组成员及分工
7、验证/再验证内容
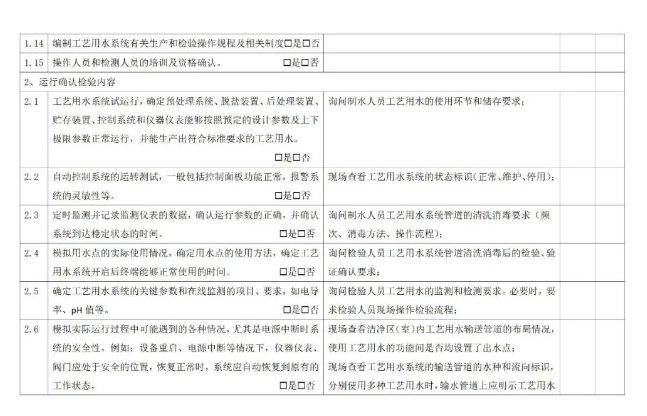
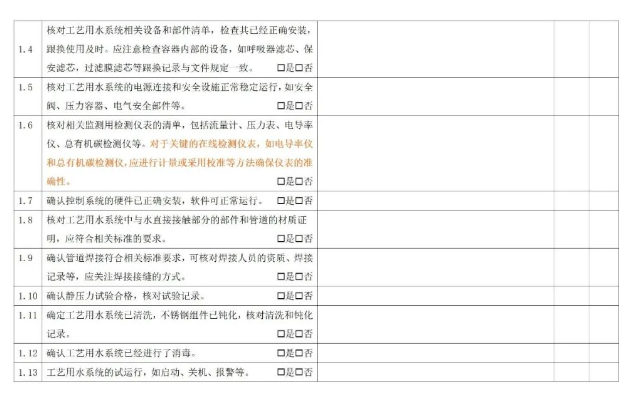
7.1 预确认
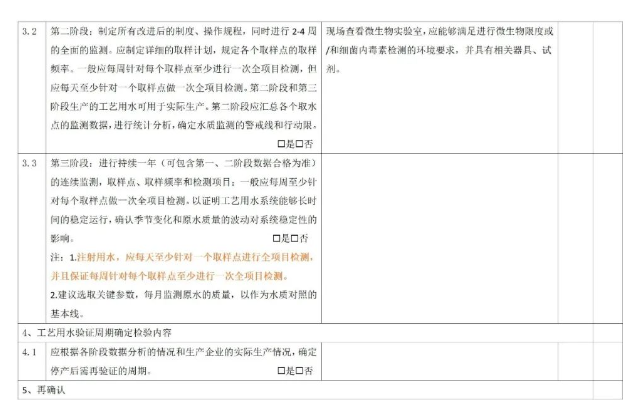
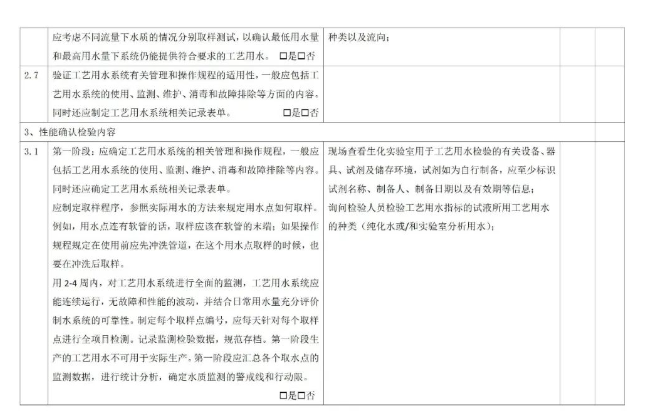
7.2 运行前确认
7.3 过程确认
7.4 上年度纯化水检测数据分析(略)
8、 异常情况处理程序
9、验证/再验证结果评定与结论
10、日常监测与再验证周期的确认
根据医疗器械生产企业应当按照《医疗器械生产质量管理规范》(国家食品药品监督管理总局公告2014年第64号)的要求,加强对工艺用水质量的管理,确保工艺用水的制备和使用不对医疗器械产品质量造成影响。
工艺用水是医疗器械产品实现过程中使用或接触的水的总称,以饮用水为源水,主要包括符合《中华人民共和国药典》规定的纯化水、注射用水和灭菌注射用水,还包括体外诊断试剂用纯化水、血液透析及相关治疗用水、分析实验室用水等。
XXXX公司简介,位于XXXX,主要生产制备XXXX,主营产品XXXX,现参照XXXX产品注册技术审查指导原则,结合产品预期用途,设计选用医疗器械工艺用水种类为XXXX。工艺用水主要用于:可作为产品的组成成分;可用于试剂的配制;可用于零部件、半成品或外协件、成品、包装材料的清洁;可用于产品的检验;可用于洁净环境的清洁;可用于洁净室(区)内直接接触产品的工装、工位器具、设施设备的清洁;可用于洁净室(区)内工作服及人员的清洁等。(结合本公司产品实际生产用水对应修订描述)
本验证方案适用于医疗器械生产工艺用水的相关管理:
①制水系统:安装、调试运行、生产操作、维护保养规范性操作;
②工艺用水:用途是否变更,制水、用水引用标准是否修订,抽取水样品合格规范操作,工艺用水检验规范,判定工艺用水检验结果准确性;
③检验工艺用水系统在制定风险防控措施适宜性、有效性;
④按照有关技术标准的规定,确保所用工艺用水的用途合理,质量符合产品生产工艺要求。
工艺用水是指:医疗器械产品实现过程中使用或接触的水的总称。
工艺用水主要分为以下几类(结合实际情况修改):
饮用水:《生活饮用水卫生标准》(GB 5749-2022);用于设备的冷却,某些零部件、半成品或外协件、成品、包装材料的清洁;
纯化水:《中华人民共和国药典》(2020年版);用于洁净环境,洁净室(区)内直接接触产品的工装、工位器具、设施设备的清洁;用于洁净室(区)内工作服及人员的清洁等;
注射用水:《中华人民共和国药典》(2020年版);用于与产品直接接触的零配件的末道清洗,储水器清洗等;
灭菌注射用水:《中华人民共和国药典》(2020年版);配料用水;
体外诊断试剂用纯化水:YY/T 1244-2014;用于试剂的配制;
血液透析及相关治疗用水:YY 0572-2015;用于血液透析和相关治疗的水,如血液透析液配制用水;
分析实验室用水:《分析实验室用水规格和试验方法》(GB/T 6682-2008);分析实验室试验时所需的用水,如标准液的配置。《化学试剂pH值测定通则》(GB/T 9724-2007);《化学试剂蒸发残渣测定通用方法》(GB/T 9740-2008)。
工艺用水主要用于:可作为产品的组成成分;可用于试剂的配制;可用于零部件、半成品或外协件、成品、包装材料的清洁;可用于产品的检验;可用于洁净环境的清洁;可用于洁净室(区)内直接接触产品的工装、工位器具、设施设备的清洁;可用于洁净室(区)内工作服及人员的清洁等。(结合本公司产品实际生产用水对应修订描述)
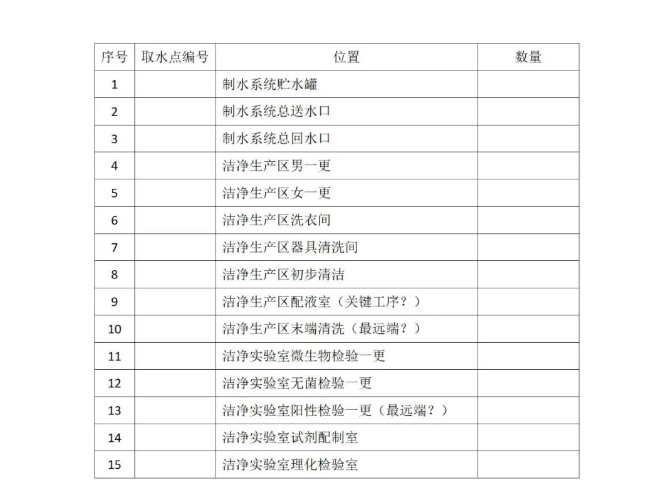
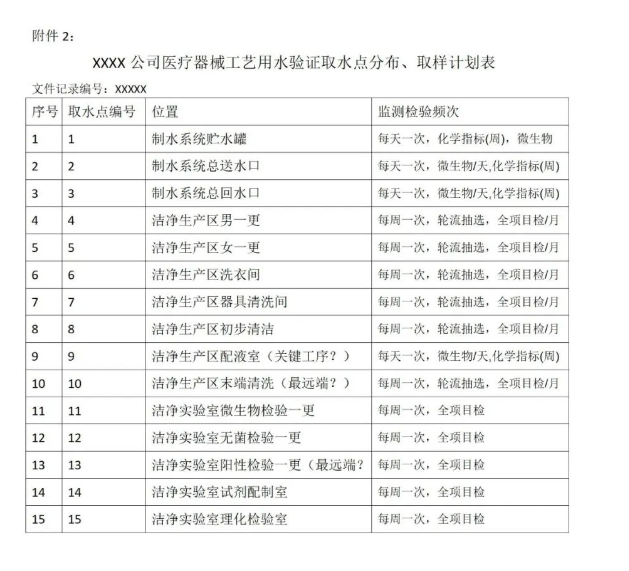
医疗器械工艺用水取水点分布
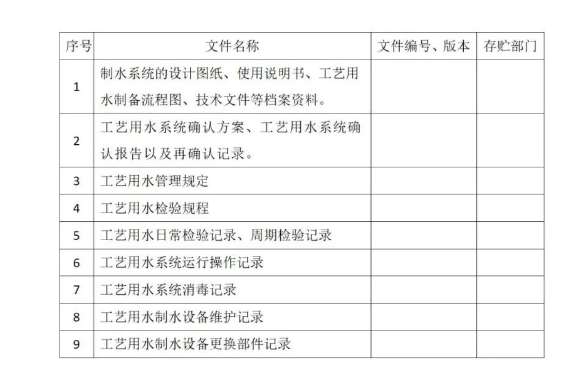
公司自有体系文件
5、验证/再验证日期
根据本公司验证小组的讨论研究,决定于XXXX年XX月XX日 至XXXX年XX月XX日对本公司工艺用水系统进行验证/再验证。
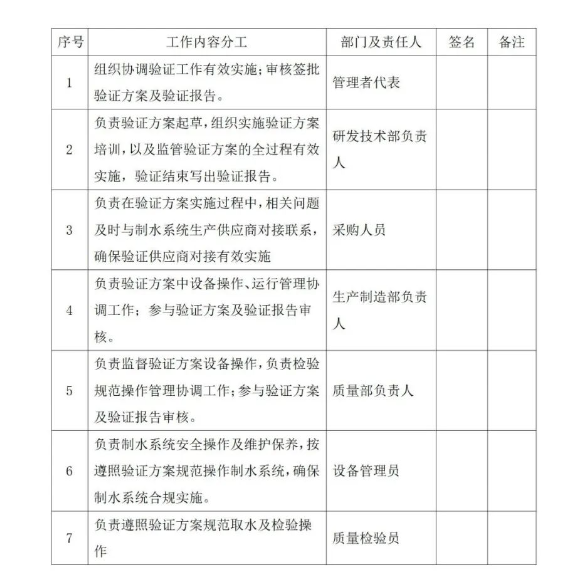
验证小组人员及职责分工

XXXX公司,主营医疗器械产品有:XXXXX,XXXX。涉及医疗器械工艺用水种类有:

纯化水设备的选择原则为:满足纯化水质量要求;满足制水效率要求;尽量减少能耗;方便维修和管理。
纯化水系统的通常流程为:一般以饮用水为原水,第一步,前处理(预处理),以去除原水中的悬浮物、胶体、微生物等杂质,并消除过高的硬度和浊度;第二步是脱盐,去除水中以离子存在的无机物、二氧化碳和氧气;第三步是后处理(精处理),进一步去除极微细颗粒、细菌和被杀死的细菌残核。
XXXX公司使用的纯化水系统为上海惠源水处理设备有限公司的1.0T/H纯化水设备,根据原水水质、生产用水量及工艺对水质的要求,采用的纯化水系统由石英砂过滤器、活性炭过滤器、阻垢剂加药系统、前置精密过滤器(5.0μm)、一级RO、二级RO、RO水箱、EDI、无菌水桶、紫外线杀菌器、终端过滤器(0.22μm)等组成,用于生产符合中国药典标准的纯化水。(结合设备实际情况修改)
运行前,对照设备流程查看各模块结构安装衔接正常,运行仪器仪表读数灵敏正常。

纯化水制备流程图:

参照现有制水系统,设备、检验作业指导书,管理制度,操作规程开展,对不同取水点进行检验。查看设备规范操作,设备稳定运行,管道正常运行传递,产品质量安全有效保障,以及制水系统风险控制措施再评价。
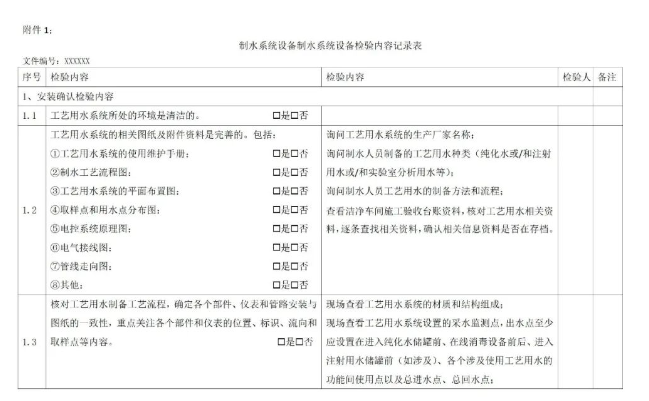
附件1:制水系统设备检验记录表。包含制水系统设备预确认、运行前确认、过程确认环节内容检验记录。
附件2:XXXX公司医疗器械工艺用水取水点分布、取样计划表。
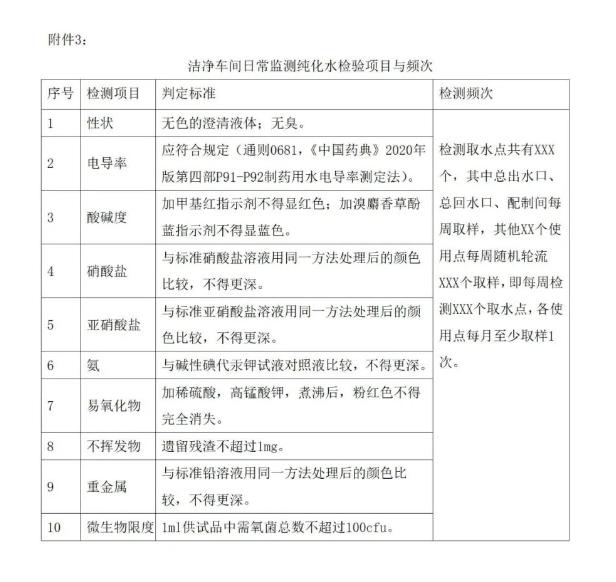
附件3:洁净车间日常监测纯化水/注射用水检验项目与频次。
在医疗器械工艺用水验证过程中,应严格按照制水系统操作指导书、工艺用水检测指导书、制水系统清洗及管路消毒指导书,如出现个别取样点纯化水质量不符合标准要求时,应按下列程序处理:
1)在不合格点重新取样,重新检测不合格项目或全项;
2)若属系统运行方面的原因,需报再验证小组,调整系统运行参数后重新检测。
系统各项再验证工作完成后,由再验证实施人员负责整理原始记录,对再验证结果进行分析与评价,并编写再验证报告,交由再验证领导小组审阅,并最终批准。
9.1 再验证情况总结(略)
9.2 再验证小组成员签字(略)
9.3 公司再验证小组组长意见和签字(略)
再验证小组负责根据纯化水系统的确认、运行情况,拟定日常监测程序及再验证周期:
纯化水经三个周期的连续运行,虽未出现水质不合格的现象,但为保证纯化水水质符合规定,需定期监测并定期对系统进行清洗消毒。
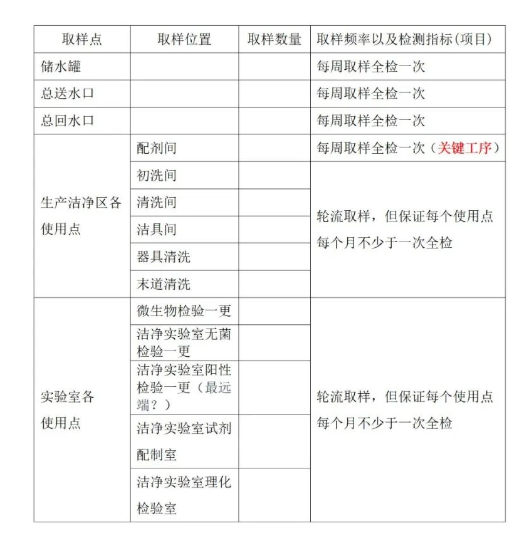
10.3.1 系统使用满一年后,必须进行再验证。系统进行再验证满3年后,若无重大异常,可每 2年进行再验证。
10.3.2 系统进行重大新建、改建或维修后,必须进行再验证。
10.3.3 纯化水正常运行一般循环水泵不得停止工作,若较长时间不用(超过1个月),在正式生产前开启纯水系统并做三个周期的检测。
纯化水系统停用五天以上或连续使用1个月应进行一次臭氧消毒。
纯化水系统再确认是指一项生产过程、一个系统(设备)或者一种原材料经过验证并在使用一个阶段以后,为证实其验证状态没有发生漂移而进行的确认。一般针对以下情况应重新确认:
1.生产一定周期后。应每年对工艺用水系统进行再确认。
2.制水系统进行搬迁的,应进行再确认。
3.工艺用水系统的维护、部件更换后,生产企业对变化情况进行记录。同时,还应根据变更部分对整体系统运行质量和稳定性的影响进行评价,必要时应进一步开展检测和再确认工作。
4.停产一定周期后应进行再确认。